在细胞药物的商业化发展中,CAR-T和干细胞治疗无疑是当前发展最为迅速和前沿的领域。这些细胞制剂的制备过程复杂且严格,对无菌控制的要求极高,以确保产品的安全性和有效性。本文将结合CAR-T/干细胞的制备过程,探讨无菌控制策略,特别是封闭化制备流程和一次性管路系统的应用。
1、细胞制备过程中的无菌控制要求
细胞制备过程中,无菌控制是确保最终产品质量和安全性的关键。无论是CAR-T细胞还是干细胞,其制备都涉及多个环节,包括样本采集、细胞分离、基因转导/转染、扩增、收获、制剂制备及放行检验等。这些步骤中的每一步都需要在严格的无菌条件下进行,以防止微生物污染。

无菌控制策略的核心在于阻止无菌的、未被污染的物质或物品与任何有菌的、被污染的物体相接触。理想情况下,所有无菌操作都应在层流式超净台中进行,且操作者需严格遵守个人卫生规范,包括穿戴洁净的实验服、乳胶手套,并使用70%乙醇或其他适当的消毒剂进行手部消毒。
2、封闭化制备流程的优势
封闭化制备流程是细胞制备过程中无菌控制的重要手段之一。封闭化制备流程通过减少操作人员与细胞的直接接触,降低生物污染的风险。这种流程通常使用自动化设备,如全自动免疫细胞培养工作站,该设备搭载一次性管路系统,在出厂时即进行预灭菌处理,且一套管路系统对应一份样本,一次性使用,用完即弃。
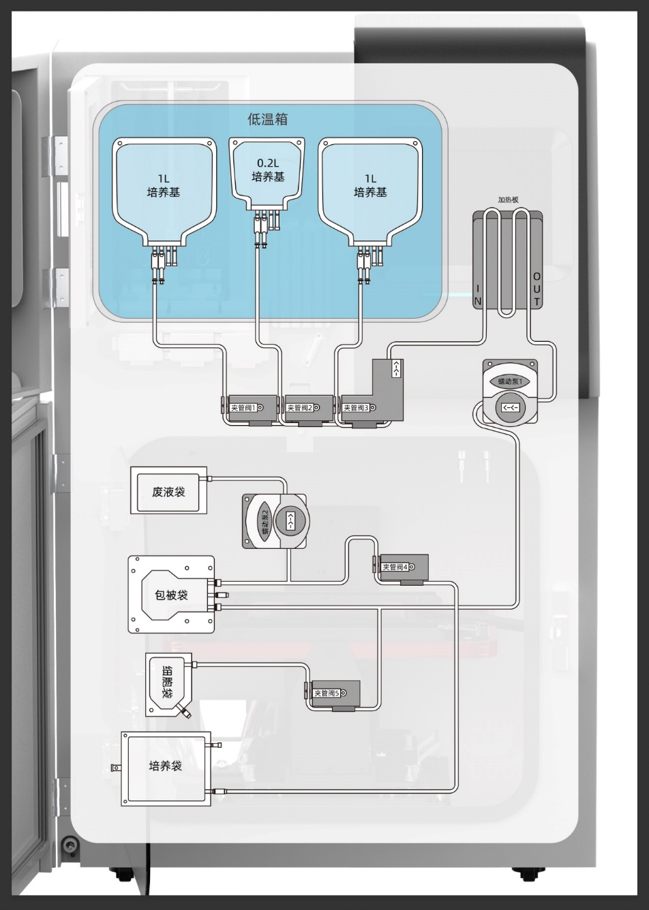
以CAR-T细胞制备为例,其制备过程包括细胞分离、基因转导、扩增等关键步骤。这些步骤在封闭化系统中进行,不仅减少了污染的风险,还提高了制备的效率和可靠性。此外,封闭化系统还能实现全流程记录,包括操作时间、操作步骤、补液量等,确保每一步操作都可追溯,从而提高了产品的质量和安全性。
3、一次性管路系统的应用
一次性管路系统是封闭化制备流程的重要组成部分。该系统采用预灭菌的一次性材料,避免了重复使用可能带来的污染风险。在CAR-T制备过程中,一次性管路系统能够确保细胞在无菌环境中进行分离、转导、扩增等操作,从而保证了产品的无菌性。

此外,一次性管路系统还简化了清洁和验证过程,降低了生产成本和时间。由于每套管路系统都是一次性的,因此无需进行繁琐的清洁和验证工作,从而提高了生产效率。
4、封闭化运行的自动化培养设备
封闭化运行的自动化培养设备是细胞制备过程中无菌控制的另一大利器。友康全自动免疫细胞培养工作站培养细胞时,在A级生物安全柜环境对接完成后,经B级环境转移进自动化封闭系统中进行细胞生产,设备及配套管路系统在运行时完全封闭,且能够实时监测和控制培养环境参数,如温度、湿度、二氧化碳浓度等,完全符合GMP管理规范。
该设备通过模块化设计,能够灵活适应不同种类的细胞培养需求,包括CAR-T、TCR-T、TIL、NK等。同时,该系统还能够实现全流程记录,包括细胞生长状态、环境参数等,确保每一步操作都可追溯。此外,设备还配备了故障警报系统,确保生产过程中的安全性和可靠性。
细胞制备过程中的无菌控制是确保最终产品质量和安全性的关键。通过采用封闭化制备流程、一次性管路系统和封闭化运行的自动化培养设备,可以显著降低生物污染的风险,提高制备效率和可靠性。这些策略在细胞药物的制备过程中尤为重要,不仅能够确保产品的无菌性,还能够提高产品的质量和安全性,推动细胞药物的商业化发展。
▲产品推荐

支原体细菌真菌检测试剂盒
1、2h出检测结果。
2、支原体试剂盒经序列比对,可覆盖100多种支原体 DNA 序列,已验证可以检测《欧洲药典EP2.6.7》、《日本药典》、《美国药典<63>》以及《人源干细胞产品指导原则2023》中要求的8种支原体,另外还可以检测生殖支原体、解脲脲原体、微小脲原体。
3、细菌试剂盒已验证可检测《中国药典》提到的5种100 CFU/mL的验证菌5种细菌。序列比对可匹配近400种验证菌的已知近源细菌。
4、真菌试剂盒可检测《中国药典》规定检测的白色念珠菌〔CMCC(F)98 001〕和黑曲霉〔CMCC(F)98 003〕,检测限达到100 CFU/mL。还可检测常见的近500种真菌。

若对相关产品感兴趣,扫码联系友康生物

 友康生物
友康生物 2024-12-05
2024-12-05 公司热点
公司热点



