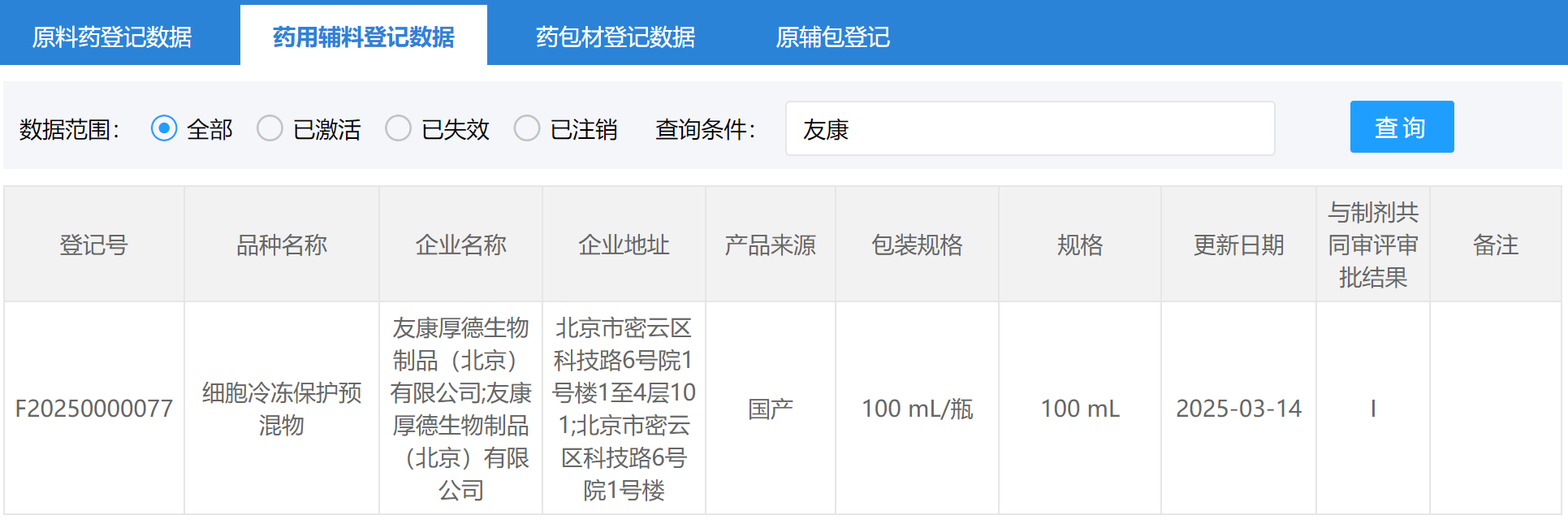
2025年3月14日,友康生物GMP级玻璃化细胞冻存液(登记号F20250000077)在国家药品监督管理局药品审评中心(NMPA-CDE)药用辅料登记备案成功并公示!
这是继该款产品取得美国FDA DMF备案后(备案号:37754)又一次重要进展,不仅有力证明了友康冻存系列产品的安全性与适用性获得国家药监部门的权威认可,也为细胞治疗产品的标准化生产与临床应用注入了一剂强心剂。
技术突破:重新定义细胞冻存安全标准
在细胞治疗行业,无论是临床应用还是药物研发,离不开细胞的冷冻保存。冻存液通常在生产细胞制剂的末期发挥作用,理想的情况下应该随细胞一起冻存复苏后制成细胞制剂应用,因此对于其安全性要求非常高。友康生物GMP级玻璃化细胞冻存液基于“YCRYO Vitrification”玻璃化冻存技术,实现三大颠覆性创新:
1、零风险配方:
无血清、无蛋白、无DMSO、所有成分均明确,杜绝细胞毒性及免疫排斥风险;
2、高效复苏性能:
细胞复苏活率稳定>90%,凋亡率低于传统冻存液30%,且无需程序降温,可直接投入-80℃保存;
3、常温储运优势:
该产品无需-20℃保存,降低运输与储存成本,适配全球供应链需求。
行业意义:推动货架型细胞制剂落地
货架型细胞制剂是细胞治疗降本增效的关键路径,但其核心瓶颈在于细胞冻存后的活性与功能维持。友康冻存液的技术优势正为此提供解决方案:
1、规模化生产:
使用本产品进行细胞冻存,无需程序降温,可直接投入-80℃过夜后,长期存放于液氮之中,操作更加简便,适配自动化产线;
2、长期稳定性:
液氮长期保存后细胞活性无衰减,细胞回收率高于传统冻存液;
3、监管协同:
继2022年完成美国FDA DMF备案后,此次NMPA登记进一步打通中美双报路径,助力药企全球化布局。
友康生物:持续引领细胞治疗上游创新
友康生物作为作为细胞治疗领域上游的研发生产供应商,专注于无血清细胞培养数十年,一直致力于免疫细胞与干细胞培养试剂的研发和创新,始终聚焦细胞治疗产业链的“卡脖子”环节:
1、研发积淀:
该款冻存液(NC1011)是友康在GMP级细胞冻存液(NC1010,21年上市)的基础上进一步研发改进推出的升级产品,冻存复苏效果更好、细胞回收率更高、使用更便捷,降低了对用户的冻存操作的要求;
2、政策响应:
响应全国政协委员“加速生产工艺突破”的提案,推动行业标准化进程;
3、生态共建:
友康生物一直以来都“以客户被评审的标准要求自己”,所有生产设备全部按照能够同时满足中国药监局、美国FDA的监管要求建设,与友康生物联合细胞药物申报的企业已经超过40多家。

若对相关产品感兴趣,扫码联系友康生物

 友康生物
友康生物 2025-03-27
2025-03-27 公司热点
公司热点



