细胞培养基产品是生物制药企业在进行药物研发和生产过程中的重要原材料之一,在抗体、疫苗、细胞治疗药物等生物制品大批量生产过程中尤为突出。作为生物制药的上游企业,为了满足客户报药的需求,从源头把控细胞培养的安全性,设立GMP净化车间来确保整个生产过程安全、高效、可重复是必要的。
Q1:什么是GMP标准?
GMP是“Good Manufacturing Practice”的缩写,意为“生产质量管理规范”或“良好生产规范”,它是一种质量管理体系,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范,以此保证产品质量可重复性,并记录此过程中的所有步骤,及时发现生产过程中存在的问题,加以改善。

Q2:实施GMP标准有什么意义?
GMP标准是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。药品的质量不是被检验出来的,而是通过将药品生产的整个过程置于科学的、严密的、严格的管理和控制之下从而对药品的质量加以保证。所以,合格的药品要满足两个条件,一个是药品本身符合质量标准,另一个就是生产的全过程必须符合GMP,这也就是强制要求药品生产企业生产环境必须达到GMP标准的原因。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
Q3:生物制药车间洁净区要求
生物制药企业车间洁净区按照ABCD的等级规则来划分,主要是以环境中的细菌数和尘埃粒子数为主要控制对象,同时,还对其环境温湿度,压差,照度,噪声等作出了规定:
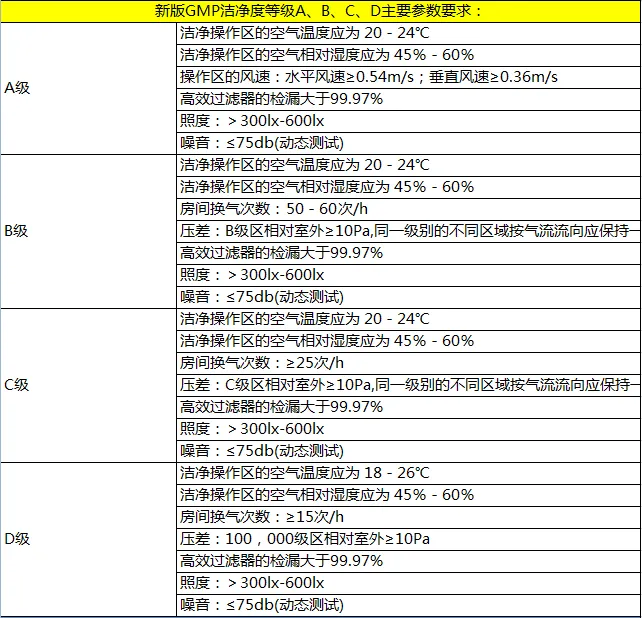
A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。应当有数据证明单向流的状态并经过验证。在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
但与常见的净化车间不同,医药GMP的要求有动静之分,而我们说的的百级、万级、十万级没有动静态之分,这两种等级划分规则有很大的区别,容易产生误区。
静态:是指洁净室或洁净区建成且设备就位,但没有人员活动、没有设备运行、没有进行生产操作时的洁净室环境状态。
动态:洁净室或洁净区设施按议定方式运行,且有规定数量的人员按议定方式活动、设备运行和生产操作时的洁净室环境状态。
制药GMP车间洁净度等级标准:
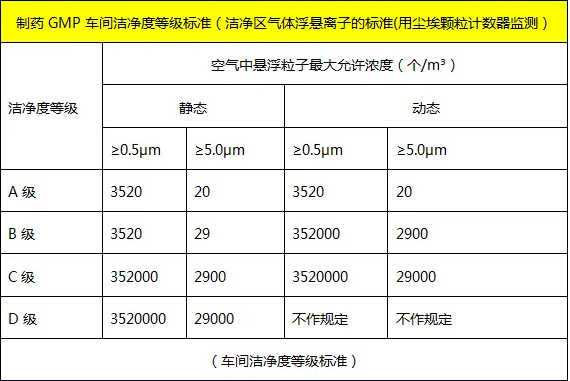
A级:对应的是动态百级,即在动态条件下应仍为百级。
B级:对应的是静态百级,即在静态条件下满足百级即可,在动态条件下可以符合万级标准。
C级:对应万级,静态条件下符合万级标准,动态条件下符合D级标准,即十万级。
D级:对应十万级。
B+A级:是指在大环境为B级洁净度的洁净室内的高风险操作区采取A级洁净度控制。
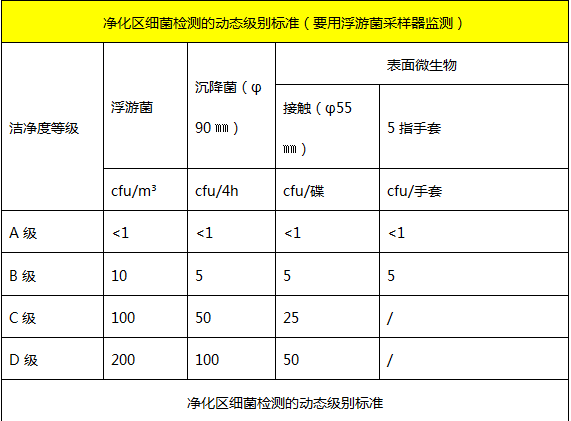
洁净区微生物监测的动态标准:
Q4:细胞产品生产操作环境的洁净度级别划分
为进一步推进细胞治疗产品相关技术的健康发展,2022年国家药监局核查中心发布了《细胞治疗产品生产质量管理指南(试行)》,全文十三章,涵盖细胞治疗产品GMP管理的基本原则、人员、厂房、设施与设备、供者筛查与供者材料、物料与产品、生产管理、质量管理、产品追溯系统等内容。
基于细胞产品的特殊性,《指南》中指出“细胞产品、直接用于细胞产品生产的基因修饰载体或其他赋予其特定功能的材料,其生产操作环境的洁净度级别可参照表格中的示例进行选择:
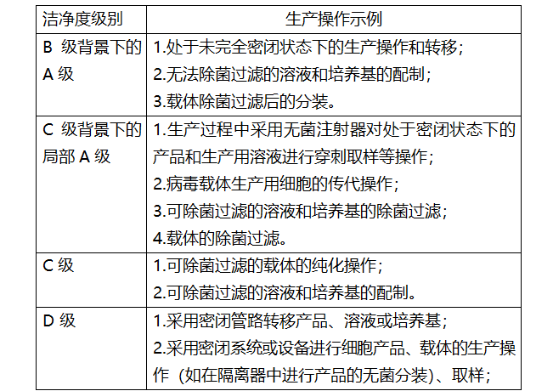

作为一家生物制药的上游企业,友康生物专注于无血清细胞培养数十年,致力于从源头处为细胞治疗领域构建稳固基石。
所有生产设备全部按照能够同时满足中国药监局、美国FDA的监管要求建设。并委托第三方机构进行检验,检测结果符合YY/T 0033-2000《无菌医疗器具生产管理规范》、GB50457-2019《医药工业洁净厂房设计规范》的工艺要求。无菌产品B+A级生产环境,与客户产成品的生产环境标准一致。能够完美支持客户在中国与美国进行药物申报与药物生产的硬件要求。

净化生产车间:12000平净化生产车间建设标准满足国内CFDA以及美国FDA的GMP车间监管要求,其中无血清细胞培养基的净化生产车间的净化程度达到静态百级、动态万级标准,产品达到同类国际领先水平。

集约式净化水系统:无血清细胞培养基最基础的物质是注射水,友康生物是迄今国内唯一一家用“注射级蒸馏水”生产液体培养基的企业。纯化水与注射水制备系统采用双级反渗透+电除盐模块,整体可消毒,实现生产过程无菌化和一体化,确保每一瓶无血清细胞培养基都能达到药典的基本要求。

全自动配液/灌装/包装系统:友康生物密云基地建设8条自动化产品配液/灌装/包装系统,年生产培养基12万瓶;全产线无菌灌装背景达到B+A级静动态洁净度,房间换气次数高于50次/h,高效过滤器的检漏率大于99.97%,为产品安全保驾护航。
通风空调工程:每个车间、实验室都配备独立空气过滤系统,空气经过三级过滤后在温度、湿度、洁净级别、出风量等方面完全符合B+A级GMP生产环境的要求。


 友康生物
友康生物 2024-12-16
2024-12-16 公司热点
公司热点



