外泌体于 20 世纪 80 年代早期首次在绵羊网织红细胞中被发现,由Johnstone 命名为“Exosome”。在很长一段时间内,外泌体都被认为是清除细胞排泄废物的“垃圾转运车”,并没有受到研究人员的重视。直到2013 年,细胞内部囊泡运输调控机制获“诺贝尔生理或医学奖”,使得外泌体作为一颗国自然新星冉冉升起,成为了液体活检新型生物标志物、无细胞治疗的重要突破口。
随着研究的不断深入,外泌体已被证明具有多种多样的功能,其功能取决于其所来源的细胞类型,可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等过程中,发挥不同功能。目前,外泌体已经被广泛应用于诊断检测、疾病治疗、药物递送等热门领域。
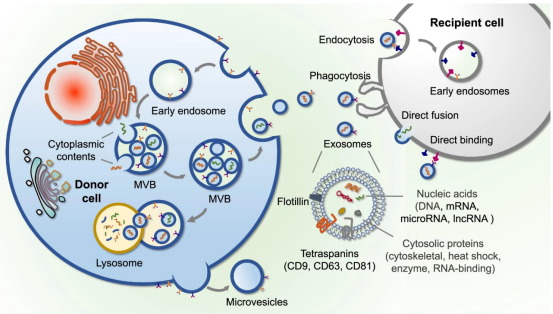
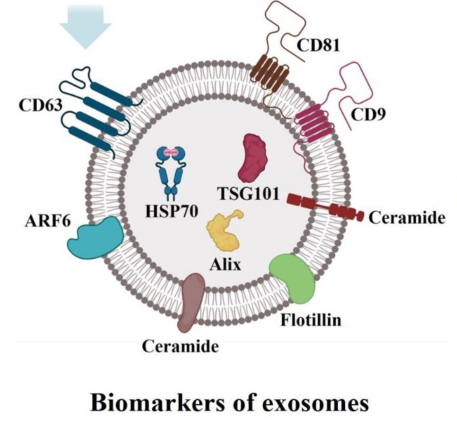
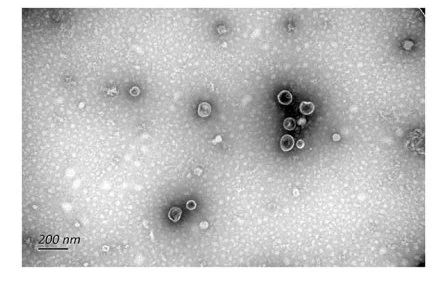
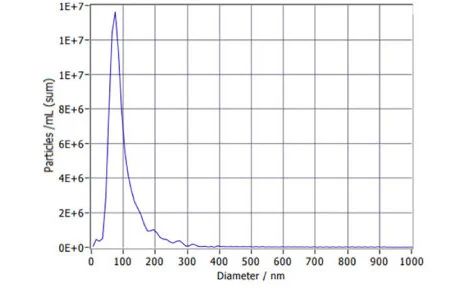
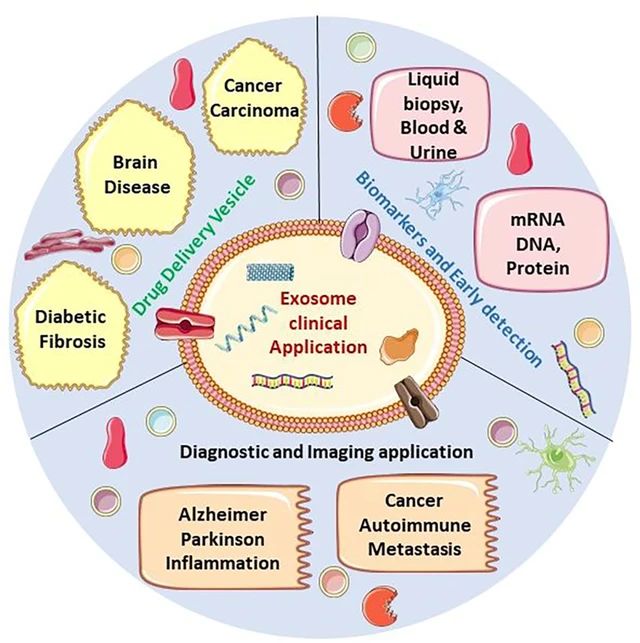
1、什么是外泌体? 外泌体是一类由活细胞主动分泌、直径为 30~150 nm、具有磷脂双分子层膜结构的细胞外囊泡。外泌体的膜主要由脂质和蛋白质组成,其内容物包括DNA、RNA、mRNA、脂质、代谢物、细胞质和蛋白质等多种生物分子。其中,细胞膜常规的四跨膜蛋白(CD9、CD63、CD81等)、热休克蛋白70(Hsc70)、溶酶体蛋白(Lamp2b)、肿瘤敏感基因101(Tsg101)、融合蛋白(CD9、flotillin,annexin)等蛋白在外泌体中的浓度较高,可作为外泌体鉴定的生物标志物。 外泌体的特征【1】 2、外泌体的来源和形成过程 外泌体的来源广泛,几乎所有类型的动物细胞都能分泌外泌体,包括免疫细胞、神经元细胞、上皮细胞、内皮细胞、胚胎细胞、癌细胞和间充质干细胞等,广泛分布于血液、尿液、唾液、乳汁、胆汁等各种体液中。 外泌体的形成主要包括起始(膜形成)、内吞作用、多囊泡体(MVBs)的形成和分选(分泌/降解/再循环)四个阶段。从质膜内陷和形成包含细胞表面蛋白和可溶性细胞外蛋白的早期分选内体 (ESE) 开始,参与内质网、反式高尔基体网络和线粒体。内质网和反式高尔基体网络也可能导致 ESE 成熟为晚排序内体 (LSE)。LSE 的第二次内陷产生具有细胞质成分和蛋白质的腔内囊泡 (ILV)。随后,LSE 通过内陷产生含有 ILV 的细胞间多泡体 (MVB)。MVB 可以通过细胞骨架和微管网络转运到质膜,并停靠在质膜的管腔侧,然后进行胞吐作用。当含有多种内容物的外泌体释放到细胞外后,在组织液中移动到邻近的靶细胞,或在循环中移动到远处的靶细胞,并通过以下几种途径将信号传递给靶细胞: ①通过表面结合配体直接刺激靶细胞; ②活化受体向受体细胞转移; ③通过传递功能蛋白、脂质和RNA对受体细胞进行表观遗传重编程。 外泌体的形成、内容物【2】 3、外泌体的分离与鉴定 目前可通过 GMP 级大规模生产获得的动物来源外泌体主要包括:骨髓 MSC 外泌体、脂肪 MSC 外泌体、树突状细胞外泌体、 HEK293 细胞外泌体等。为了在研究和临床中更加有效地利用外泌体,从生物样品中精确地将外泌体分离出来至关重要。外泌体的分离和富集主要通过差速超速离心、密度梯度超速离心、过滤、超滤、超滤与超速离心结合、试剂盒提取等传统方法;此外,微珠、微流控芯片和热泳技术等新技术的应用也使得外泌体能够更加快速、方便地富集。 那么分离富集之后,我们又该如何鉴定提取出来的物质是外泌体呢? 1) 外泌体蛋白分析(Western Blot) 采用抗原抗体特异性相结合的原理,可以鉴定外泌体中存在的特定蛋白,能证实外泌体成分的存在,其中,CD63、CD9、CD81以及TSG101、HSP70、HSP90、ALIX等是最常用到的外泌体标志物。 外泌体标志物【3】 2)外泌体形态和粒径分布分析 透射电子显微镜(TEM)被认为是识别和表征单个外泌体的常用方法,可以直观地观察外泌体形态和大小。TEM视野下,外泌体呈圆形或杯状结构,大小范围为30-150nm。 外泌体形态和粒径分布分析【4】 纳米颗粒跟踪分析(NTA)是一种广泛用于确定外泌体浓度和尺寸分布的方法。通过光学原理感知粒子的存在,可以从整体上对外泌体数量和直径的群体特征进行检测,外泌体的粒径分布区间在30-150nm。 外泌体形态和粒径分布分析【4】 4、外泌体的临床应用前景 外泌体的临床应用【5】 ▲外泌体作为载体用于药物递送 外泌体作为天然的药物递送载体,具有比现有靶向治疗的药物载体更好的稳定性和生物相容性。可通过基因工程和化学修饰来提高药物靶向细胞或器官的能力,从而限制药物对正常组织和细胞的伤害,减轻药物毒副作用。 外泌体载药技术分为两类:外源性载药技术和内源性载药技术。外源性载药技术是从细胞培养液或其他生物体液中分离和纯化外泌体,并通过物理或化学手段将所需药物负载至外泌体表面或内部;而内源性载药技术是通过生物工程技术改造的方式使供体细胞产生包含特定药物的外泌体。 通过不同的载药方式,外泌体可以负载不同的药物,通过与源细胞特殊的亲和作用、归巢效应等自然趋向作用,将负载的药物运送到靶向组织。而在外泌体中加载其他药物,或者进行工程化修饰,能赋予它们对特定组织、受体细胞的选择性,改变体内分布,实现更高效的药物靶向递送,从而提高治疗效果。 ▲外泌体作为生物标志物用于疾病诊断 由于外泌体具有脂质双分子层的稳定结构,即使在恶劣的肿瘤微环境下也能够稳定循环,而且体液中包含大量外泌体,其携带的内容物能够反映亲本细胞的生理病理特征。因此外泌体成为液体活检中最具潜力的新型生物标志物。据报道,外泌体蛋白和外泌体RNA均可成为癌症早期诊断标志物: 如脑脊液外泌体中的miRNA包括let-7f-5p、miR-27a-3p、miR-125a-5p、miR-151a-3p和miR-423-5p可作为生物标志物用于帕金森病的早期诊断,从分子水平发挥疾病诊断的精确作用;血清外泌体中的miR-155与肝硬化的进展和肝硬化的临床预后指标密切相关,表明富含miR-155的外泌体可作为肝纤维化诊断和进展的非侵入性生物标志物;此外,外泌体miRNA-10b是胰腺癌进展相关的公认指标之一,广泛用于胰腺导管腺癌的早期诊断。在非小细胞肺癌中,其患者和健康者之间血液中外泌体miRNA-21、miRNA-378、miRNA-139和miRNA-200存在差异表达,也为早期诊断提供了更多可选的生物标记物。 ▲外泌体有效成分用于疾病治疗 外泌体在治疗多种疾病方面显示出巨大潜力,以外泌体为代表的无细胞疗法极大地扩展了包括癌症在内的多种疾病的治疗方法。 据报道,间充质干细胞来源外泌体可以直接递送功能性蛋白和 RNA,例如 miRNA,进而调节细胞凋亡相关蛋白并降低细胞化疗耐药性。来自免疫细胞的外泌体也可以直接杀死肿瘤细胞。已知 NK 细胞通过裂解颗粒中的细胞毒性物质来发挥细胞毒性,其表面的跨膜蛋白 Fasl 决定了靶细胞的命运。与 NK 细胞相比,NK 细胞的外泌体富集更多的 Fasl 和穿孔素蛋白,并且具有更强的杀死肿瘤细胞的能力。在心血管疾病的研究中,由间充质干细胞来源的外泌体递送的生物活性分子(如 microRNA-132)可促进心肌梗死中的血管生成。外泌体可以促进心肌细胞的增殖和修复,也可以改善小鼠的心脏功能。 参考文献 【1】Raghu Kalluri, Valerie S. LeBleu ,The biology, function, and biomedical applications of exosomes.Science367,eaau6977(2020).DOI:10.1126/science.aau6977 【2】Yu, D., Li, Y., Wang, M. et al. Exosomes as a new frontier of cancer liquid biopsy. Mol Cancer 21, 56 (2022). https://doi.org/10.1186/s12943-022-01509-9 【3】Hade, M.D.; Suire, C.N.; Suo, Z. Mesenchymal Stem Cell-Derived Exosomes: Applications in Regenerative Medicine. Cells 2021, 10, 1959. https://doi.org/10.3390/cells10081959 【4】Li X, Wang W, Chen J, et al. The potential role of exosomal miRNAs and membrane proteins in acute HIV-infected people. Front Immunol. 2022:13:939504. 【5】Huda MN, Nafiujjaman M, Deaguero IG, Okonkwo J, Hill ML, Kim T, Nurunnabi M. Potential Use of Exosomes as Diagnostic Biomarkers and in Targeted Drug Delivery: Progress in Clinical and Preclinical Applications. ACS Biomater Sci Eng. 2021,7(6):2106-2149. 友康生物自成立以来,一直致力于干细胞领域无血清细胞培养试剂的研发和创新,以干细胞领域的深厚积淀为基石,巧妙地将探索的触角延伸至间充质干细胞外泌体这一生物领域。通过对间充质干细胞生产外泌体机制的大量研究,目前已经在干细胞外泌体大规模增产方向上取得一定进展。 友康推出以“外泌体专用培养基+间充质干细胞外泌体增强剂+多孔空心微载体”为基础的干细胞外泌体大规模增产方案。通过大量的实践发现,该方案可以大幅提高外泌体的产量,增加可溶性细胞囊泡颗粒浓度。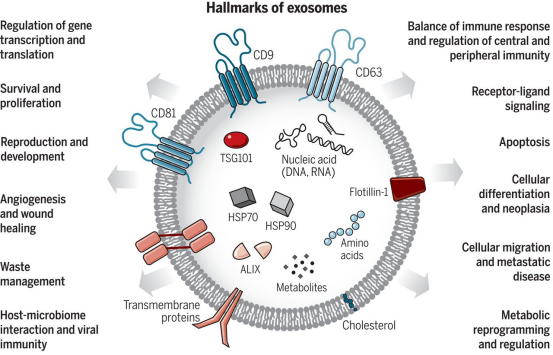

若对相关产品感兴趣,扫码联系友康生物

 友康生物
友康生物 2024-12-11
2024-12-11 公司热点
公司热点



