近日,友康生物间充质干细胞无血清培养套装(NC0103+NC0103.S)成功获得了美国FDA的510(K)二类医疗器械注册证,510(K)号K232543。这不仅是中国首个,也是全球范围内第二个获得此殊荣的干细胞纯因子套装培养基产品。这一里程碑式的成就,不仅彰显了友康生物在干细胞培养基领域的领先实力,更为中国干细胞治疗行业的国际化进程提供了强有力的支持。然而由于国内外培养基监管体系的不同,很多客户提出疑问:
1、 FDA 510(K)究竟是什么申报?
2、 友康生物坚持申报510(K)的意义是什么?
3、 510(K)与DMF又有什么区别?
针对以上问题,本期我们特此进行详细解答。

Q1、什么是510(K)申请?
1976年美国通过了联邦食品、药品和化妆品(FD&C)法案医疗器械修正案(MDA)。在MDA指导下FDA颁布法规将当时所有市售器械列为三种管制类别:I类、II类、III类:

其中,III类器械通常需要上市前批准(PMA),而如果制造商计划在美国销售预期用于人体且无需上市前批准申请的I类、II类或III类器械,则必须向FDA申报上市前通知(Premarket Notification),即510(K)。因此,FDA 的510(K)申请又叫上市前通报,是FDA针对中度风险的医疗器械(大多数是Ⅱ类产品)的一个注册审批程序。由于这个审批流程最早是在FD&C法案里面第510条的(K)章节里面规划并实施的,故通常称510(K)文件。
Q2、为什么要申请510(K)?
(1)FDA对细胞培养基的要求:2011年美国FDA 发布了Class II Special Controls Guidance Document: Tissue Culture Media for Human ex vivo Tissue and Cell Culture Processing Applications-Final Guidance for Industry and FDA Reviewers (II类特殊控制指南文件:组织培养基用于人体离体组织和细胞培养处理应用-工业和FDA审评的最终指南)该指南明确表明,体外培养用细胞培养基归属于二类医疗器械监管,只有通过510(K)注册后,才能应用于临床。
(2)获得510(K)的意义:在医疗器械的开发和上市过程中,获得 FDA 510(K)许可是一个关键步骤。510(K)提交过程复杂、繁琐且具有挑战性。为了保证510(K)所有申请材料的正确性和完整性,FDA引入了“Refuse-to-Accept”机制,意思是收到RTA信件之后有180天的时间来修正和补充所有遗漏或不正确的申请材料。此外,FDA审查一般会细分到很多不同的审查员,不同审查员将审核产品各个方面,包括基于风险方式确定生物相容性评价、生物安全测试的总体考虑、生物安全测试针对特定实验的考虑乃至标签标注的考虑等,这无疑增加了审核通过的难度,只要有一个审查员拒绝,那么整个过程就会暂停或中断。作为最严格的药品和医疗器械监管机构之一,FDA的认证标准被全球广泛认可,因此虽然510(K)的注册证获取极难,且花费较多,耗时很长,但仍被业界公认为是进入全球医疗市场的金钥匙。
Q3、FDA对510(K)实质等同的认可标准是什么?
FDA对510(K)申报的决定基于器械与合法上市(同品种)器械是否实质等同(SE),安全性和有效性原则是所有510(K)审查时判定实质等同的基础。然而,必须注意的是,实质性等同并不要求新器械与同品种器械完全相同。在510(K)背景下,FDA一定程度上依赖于其既往判定,即同品种器械存在合理的安全性和有效性保证。FDA通过评估新器械与同品种器械之间的差异,以确保它们不会引起新的安全性或有效性问题。这种评估包括审查用于评估差异和性能数据的科学方法,以及医疗用途、设计、使用的或传送的能源、材料、性能、安全性、有效性、标注、生物相容性等进行综合判断。
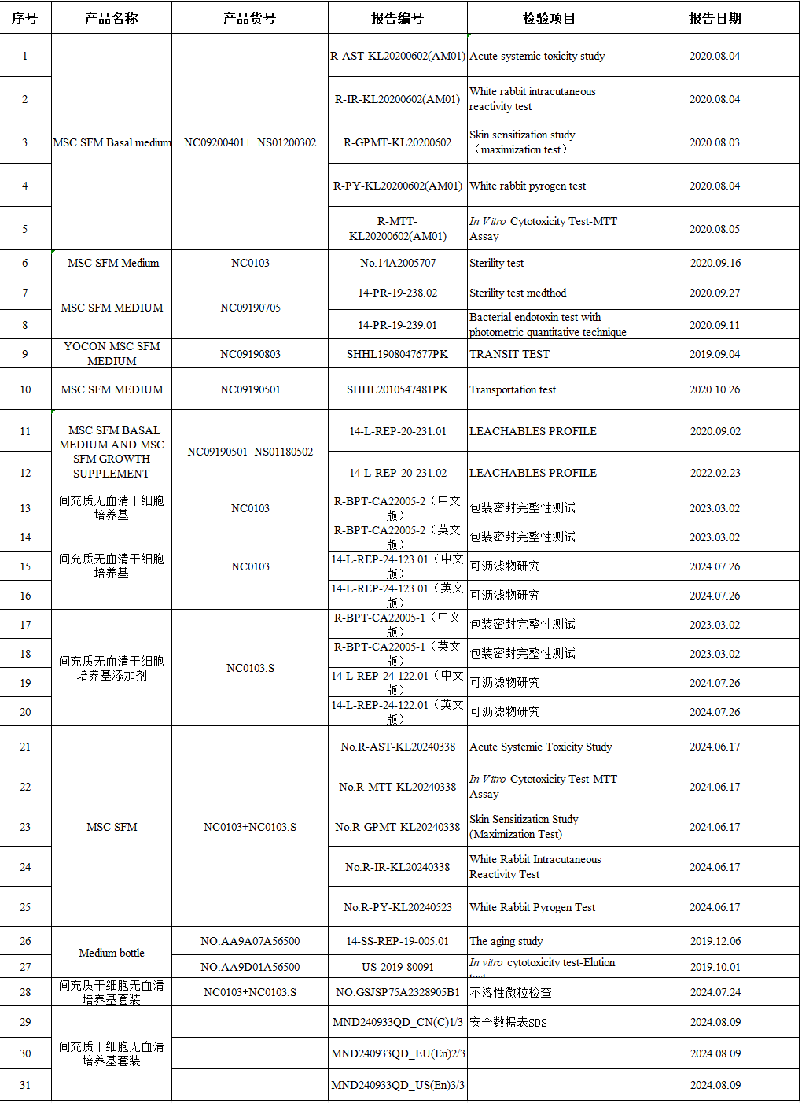
以友康生物K232543的申报过程为例,在向美国FDA提交间充质干细胞无血清培养基的510(K)申请期间,我们递交了包括包装密封完整性测试、不溶性微粒检查、可沥滤物研究、急性全身毒性研究、白兔皮内反应性试验、皮肤致敏研究、白兔热原试验、体外细胞毒性试验、无菌试验等几十项干细胞培养基相关检测报告,并且这些报告均是由美国FDA认可的国际权威三方检测机构出具,具有极为严格的检测标准,其含金量可见一斑。
Q4、什么是DMF备案?
药物主文件,即Drug Master File (DMF),是提交美国FDA的存档待审资料,属于备案。资料内容包括制造、加工、包装、储存、批发人用药品活动中所使用的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。通常由药品原料、药品包装和助剂的制造商或供应商向FDA提交。DMF具有以下两个特点:
(1)保密性:DMF持有者向FDA呈交DMF主要目的是支持用户向FDA提交的各种药品申请,而同时又不愿将其化学和生产流程的保密资料抄报用户。
(2)简化性:在FDA中心档案室存档的DMF可以支持所有使用该产品的用户,DMF持有者无须向每一用户重复提供资料。
Q5、FDA对DMF有什么审查要求?
因为DMF审查是由其用户的药品申报而引起关联性审查,一般情况下FDA只对DMF做形式审查,即DMF资料上交后仅是编号备案,FDA并不负责审批已备案的DMF资料,也不对DMF资料发表观点。只有当DMF的用户向FDA申报制剂药品申请(IND、NDA、ANDA)及其修正或补充后,FDA才开始对DMF文件进行审核和评估,以确保其符合规定的要求。
Q6、FDA 510(K)和 FDA DMF有哪些区别?
FDA 510(K) | FDA DMF | |
定义 | 医疗器械上市前通报,是FDA针对中度风险的医疗器械(大多数是Ⅱ类产品)的一个注册审批程序。 | 药品资料档案,用于提交药品、原料药、包装材料、助剂、配方和工艺等有关资料的注册文件。 |
目的 | 证明新器械安全性和有效性与市场上已存在的类似器械相当,以便在美国市场销售。 | 支持用户向FDA提交各种药品上市申请时无需重复提供资料,且资料内容保密。 |
审查要求 | 注重与已批准器械的实质等同性或基于相同技术或原理的证据,在新器械上市前需依据安全性和有效性原则提交各种资料,获得FDA批准后才可销售。 | 一般FDA只备案不审查,只有当授权下因其用户的药品申报而引起关联性“审查”。 |
作用 | FDA医疗器械的管理规范,医疗器械进入美国市场的必要条件。 | 药品制造商或供应商向FDA提供信息的一种方式,有助于提高审批效率,加速药物申报进程。 |
写在最后
关于510(K)注册本身对国内申报注册证获取的实际助益,业界始终存在不同声音。作为近年来蓬勃发展的新兴领域,细胞治疗行业的法律法规正处于持续完善与细化的进程中,观点分歧在所难免。但不可否认的是,友康510(K)注册证的获取,无论在实质上是否可以减轻国内申报的难度,在这五年实地申报过程中友康投入大量精力和时间所做的数十项安全性检验都是毋庸置疑的。
目前市面上成功拿到510(K)注册证的除友康间充质干细胞无血清培养套装之外仅有少数基础培养基以及一款临床级无血清完全培养基,这凸显了注册门槛之高,也说明只有组分相对单一的基础培养基或者化学成分完全明确的完全培养基才具备注册510(K)的可能性。相比之下,血清及血清替代物因成分复杂,难以通过多项安全性检验且无法证明实质等同,故难以获得此认证。而友康的产品经过严格的技术检测,确保了其在人体应用中的高度安全性。
此外,FDA作为全球最严格的药品和医疗器械监管机构之一,将细胞培养基归属于二类医疗器械监管,并要求只有通过510(K)注册后才能应用于临床,这同样代表了美国市场的态度与标准,他们认为这些检测是非常有必要的。友康坚持依靠自己扎扎实实的研发生产工作服务好客户,用数据和证据说话,而绝非空谈与噱头。毕竟干细胞研究的关键是迈向临床试验,友康致力于将经过全面验证的工具交到细胞治疗领域的研究者手中,获得FDA 510(K)认可正是在此道路上迈出的关键一步,彰显了友康致力于“为我们的客户提供更安全、更便利的产品和服务”的承诺以及“为世人的生命健康贡献力量”的企业使命。
间充质干细胞无血清培养基
●专为脐带来源的间充质干细胞特别开发,也可培养胎盘、骨髓、牙髓等来源的间充质干细胞。
●真正无血清纯因子培养体系,无人源无动物源,更适合干细胞报药与临床实验研究。
●产品性能优异,连续传代至P20依然保持间充质干细胞的表面特征稳定。
●已获美国FDA二类医疗器械注册受理510(K)号:K232543,为国内首家获得FDA二类注册受理的干细胞培养基。

若对相关产品感兴趣,扫码联系友康生物

 友康生物
友康生物 2024-10-22
2024-10-22 公司热点
公司热点



