在再生医学和疾病治疗领域,间充质干细胞(Mesenchymal Stem Cells, MSCs)因其强大的组织修复和免疫调节能力备受关注。然而,近年来研究发现,MSCs的许多治疗作用并非直接由细胞本身介导,而是通过其分泌的外泌体(Exosomes)实现的。这些直径约30-150纳米的囊泡,携带着丰富的生物活性物质(如蛋白质、核酸、脂质等),能够精准调控细胞间通讯,在疾病治疗中展现出巨大潜力,被誉为医学界的“纳米特快”。
间充质干细胞外泌体:细胞间的“信息快递” 外泌体是细胞分泌的纳米级囊泡,作为细胞间的“分子快递员”,能够将母细胞的生物信息传递给靶细胞,从而调控其功能。与传统干细胞疗法相比,MSC-Exos具有低免疫原性、高稳定性、易储存运输、无伦理争议等优势,且能避免细胞移植导致的潜在风险(如畸胎瘤形成)。 MSC-Exos继承了MSCs的多种治疗特性,主要包括抗炎与免疫调节、促进组织修复、抗纤维化与抗凋亡等作用。因而其被广泛应用于以下多个领域: 1. 心血管疾病 MSC-Exos可通过递送miR-21、miR-210等促进心肌细胞存活,减少缺血再灌注损伤,改善心功能。动物实验显示,外泌体治疗可减少心肌梗死面积达40%以上。 2. 神经系统疾病 在阿尔茨海默病、帕金森病等神经退行性疾病中,MSC-Exos能够穿越血脑屏障,通过调节神经炎症和促进突触再生发挥治疗作用。例如,外泌体携带的miR-133b可促进神经元轴突再生。 3. 抗衰老与皮肤修复 外泌体富含的胶原蛋白和弹性蛋白mRNA可促进真皮成纤维细胞增殖,减少皱纹形成。临床研究显示,外泌体可显著改善皮肤光老化。 4. 肿瘤治疗 MSC-Exos具有双重作用:一方面可作为药物载体靶向递送抗癌分子(如化疗药物、siRNA);另一方面,其本身可通过调节肿瘤微环境抑制转移(如通过miR-16抑制血管生成)。 间充质干细胞外泌体制备的难点 尽管MSC-Exos前景广阔,但其规模化生产仍面临重大挑战,产能不足、纯度不高等问题使外泌体治疗产品难以满足临床和商业化的需求,这些仍是目前亟待解决的问题。 1、外泌体制备方式受限 目前MSC-Exos比较普遍采用手工培养和生物反应器自动化培养两种方式。手工培养产能较低、批次间差异较大,污染风险较大,难以满足外泌体疗法的临床需求。而生物反应器自动化培养虽然更安全、规模更大,但其仅适用于具有固定生产批次的大规模制药企业,不适用于大多数处于中间状态的初创型企业。 2、外泌体培养体系受限 MSC-Exos的培养体系不仅与其产量息息相关,更关系到外泌体的纯化工作,影响最终的纯度和实际效用。在传统的血清培养体系中,因其本身含有大量动物源外泌体,叠加细胞分泌的外泌体后,会出现“高产假象”,其中细胞源性外泌体占比极低(≤30%),其余均为类似外泌体尺寸的杂质。此外,血清体系培养也会使得后续的外泌体分离步骤效率很低,从而影响最终使用效果。 高品质外泌体的低成本制备技术 针对外泌体制备的难点,友康推出了集设备、试剂、耗材于一体的基于预封装3D微载体的全自动外泌体制备技术,以更低的成本,拥抱高品质、自动化、便捷化的外泌体生产技术。 1、设备:外泌体培养工作站 外泌体培养工作站是专为大规模、高效自动化生产间充质干细胞外泌体设计的智能化设备。通过间歇式震荡,全自动完成干细胞外泌体的培养与收获。比生物反应器成本更低、使用更方便,比手工培养更安全、规模产能更高大,为企业提供了一种高品质、低成本的外泌体制备方式。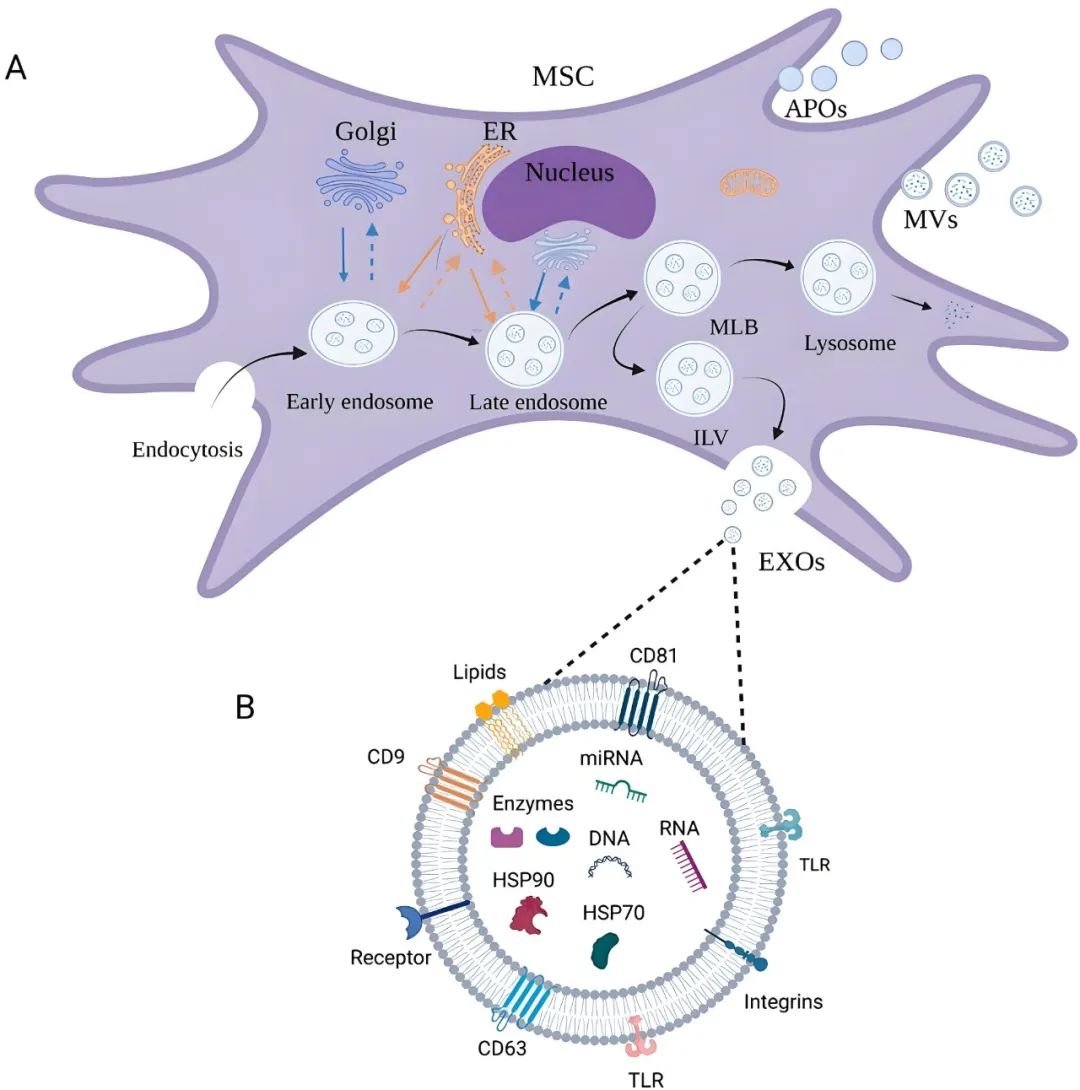

2、耗材:预封装3D微载体FEP无菌封闭管路系统 设备搭载预封装3D微载体FEP无菌封闭管路系统,即取即用,无需预灭菌。管路系统采用FEP、医用级的硅胶管等材料,通过友康自研的自锁互联接口相连。设备及配套管路系统在运行时完全封闭,对设备所处外部环境要求不高,确保培养结果的安全性。 3、试剂:GMP级间充质干细胞无血清培养基2.0 培养基采用无血清纯因子培养体系,无人源无动物源,所有蛋白均为人工重组,适用于干细胞药物申报与临床细胞库的建立,已获FDA DMF备案(备案号:31623)。 培养基背景外泌体含量极低,有助于简化后续纯化工作、提高外泌体纯度,外泌体纯度可达90%以上。 通过外泌体工作站培养,一个培养周期15天,需要5L培养基,最终可收获外泌体数量约25万亿。 间充质干细胞外泌体以其高效、安全、多效性的特点,正在改写疾病治疗的格局。从心血管修复到神经再生,从抗衰老到抗癌,这颗“纳米级明星”正飞速驶向临床应用的快车道。随着研究的深入,MSC-Exos或将成为下一代生物医药的支柱技术,为人类健康带来革命性突破。而自动化培养技术也将会进一步推动干细胞外泌体产业的发展。

 友康生物
友康生物 2025-09-30
2025-09-30 公司热点
公司热点



