在癌症治疗领域,传统疗法如手术、化疗和放疗虽应用广泛,但对部分晚期或难治性癌症患者效果不佳,且存在副作用严重、易复发等问题。近年来,细胞疗法作为新兴治疗手段,为癌症治疗带来新曙光,尤其是通用型细胞疗法,其优势显著,有望成为癌症治疗的重要突破方向。
一、什么是通用型细胞疗法?
通用型细胞疗法是指利用健康供者的细胞,经过基因编辑、免疫调控等技术处理,使其能够逃避免疫排斥,可用于治疗多种疾病,特别是癌症的一种细胞治疗技术。
由于人体免疫系统通过识别细胞表面的主要组织相容性复合体(MHC)来区分自身与外来细胞,为避免宿主免疫系统对供体细胞的攻击,科学家运用基因编辑技术,如CRISPR-Cas9等,敲除或修改供体细胞的 MHC基因,降低免疫原性。其核心在于对供体细胞进行精准改造,以克服免疫排斥反应。
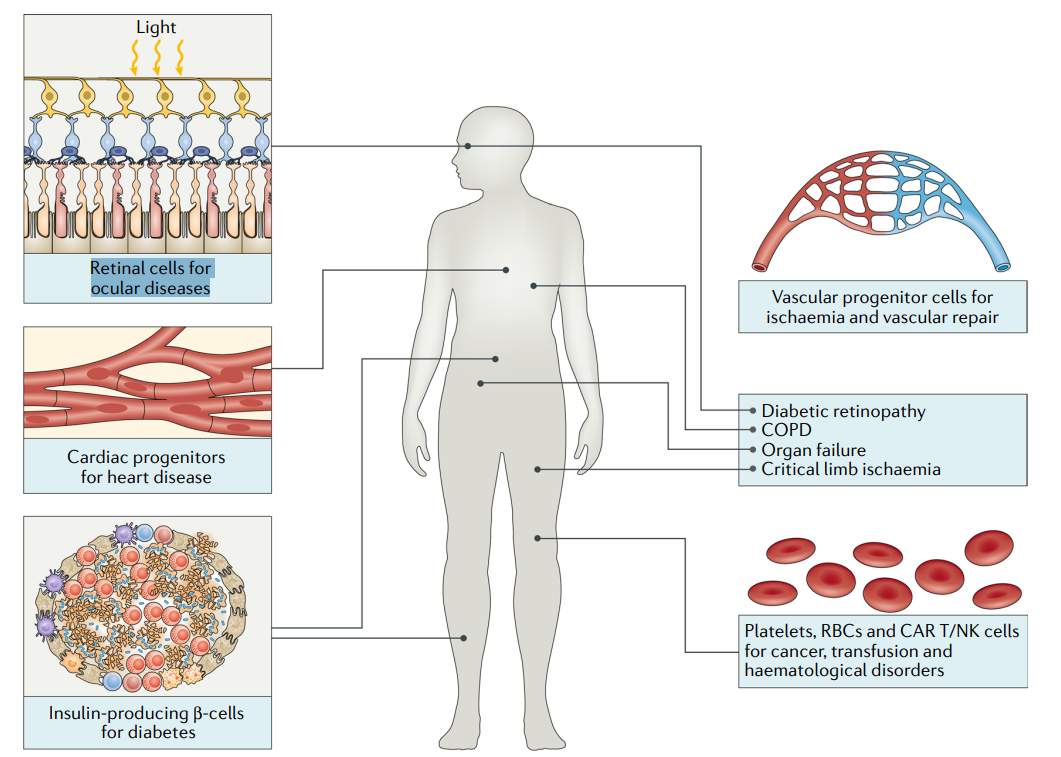
一些可能用不同类型的通用细胞治疗的疾病示例
二、为什么需要“通用型”细胞疗法?
传统细胞疗法需提取患者自身细胞,经基因改造后回输体内。这种“私人订制”模式存在三大痛点:
1. 时间长:制备通常需3-6周,晚期患者可能错过最佳治疗期;
2. 成本高:自体CAR-T单剂费用接近或超百万元;
3. 适用窄:体弱或淋巴细胞衰竭的患者无法生产合格细胞。
基于此,通用型细胞疗法应运而生。由于通用型细胞疗法使用的免疫细胞来自健康捐赠者,可以预先制备并储存,实现“现货供应”,从而降低成本、缩短制备周期,并扩大患者群体。
三、技术路径:如何实现“通用化”?
1. 基因编辑型:给细胞穿“隐身衣”
-原理:利用CRISPR技术敲除T细胞中引发排斥的基因(如HLA、TCR),使其不被患者免疫系统攻击,降低移植物抗宿主病(GVHD)风险。
UCAR-T是目前最成熟的通用型细胞疗法。除了将CAR转导到T细胞中外,还可以敲除或抑制TCR以预防GVHD。MHC-I和/或MHC-II的基因消融会降低免疫原性。CD52的破坏可使细胞对阿仑单抗产生耐药性。CD7被编辑以防止UCAR-T细胞中的自相残杀。此外,还可以敲除抑制性检查点(例如 PD-1)以增强细胞的功能。
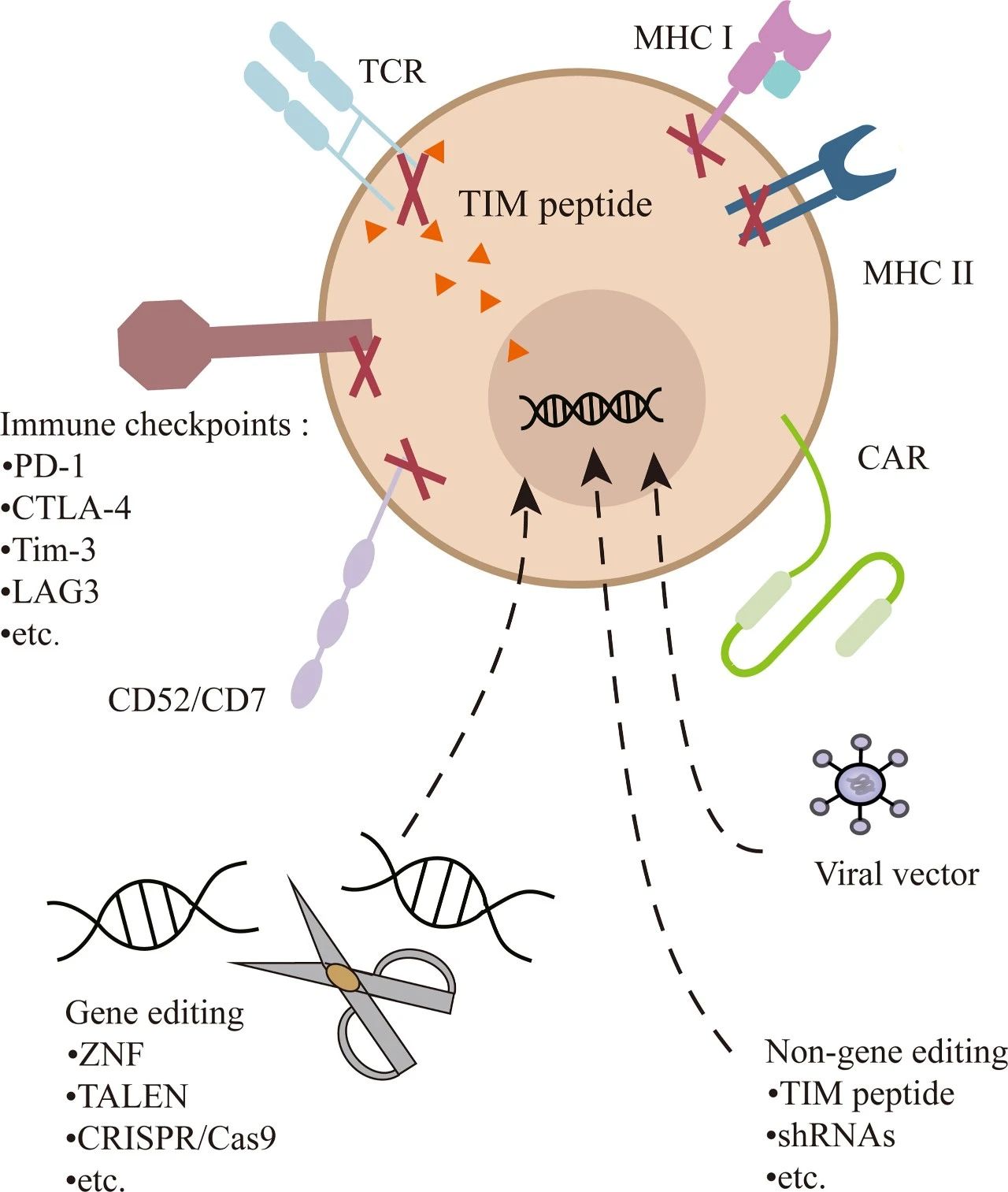
对 UCAR-T 细胞进行多基因或非基因编辑
制造UCAR-T细胞的第一步是从外周血单核细胞(PBMC)中收集供体T细胞,然后通过磁珠技术分离T细胞,再将CAR基因通过慢病毒转导到收集的T细胞中。为了限制GVHD和HVGR的发生,采用基因编辑技术来敲低同种异体反应基因(例如TCR和 CD52)的表达。获得稳定的UCAR-T细胞后,需要大规模体外扩增以获得所需的剂量,扩增的UCAR-T细胞经过进一步纯化以确保安全性。最终,这些细胞被冷冻保存并随时可以输注给多名患者。
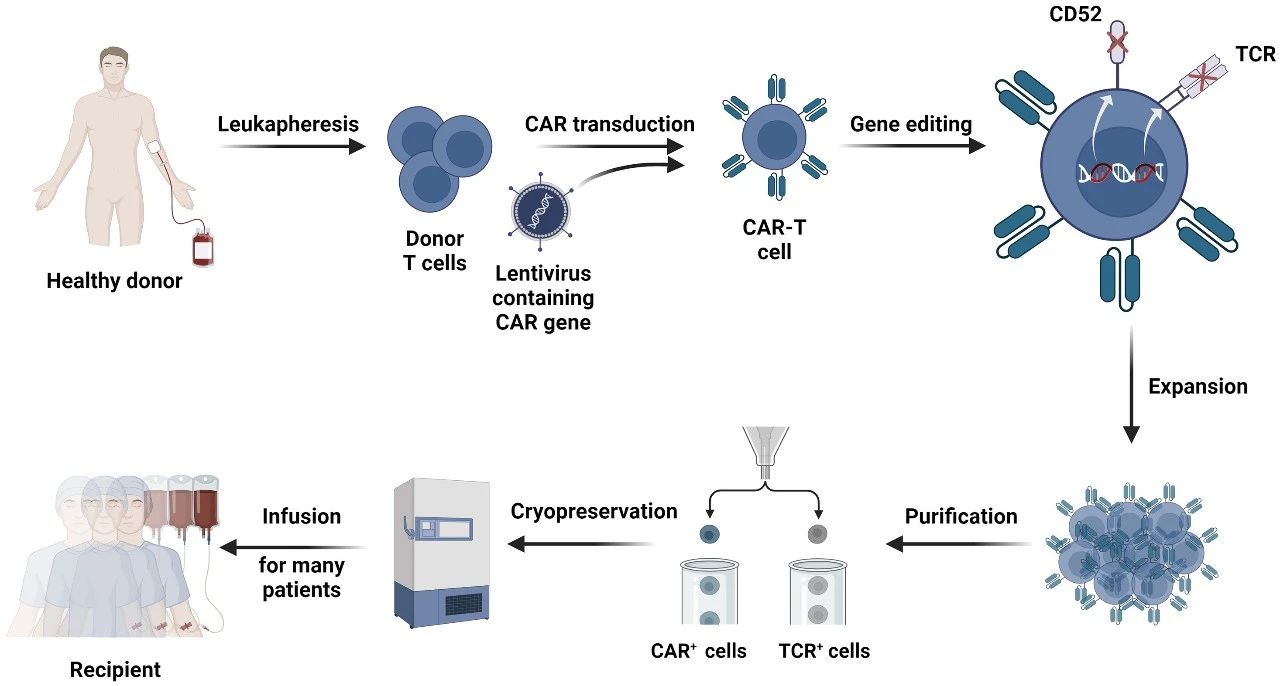
UCAR-T 疗法的常规生产路线
2. 天然免疫细胞:大自然的“异体兼容”卫士
-原理:通过激活或改造固有免疫细胞(如 NK、NKT、γδT 细胞)实现抗肿瘤和抗病毒效应,其核心优势在于无需抗原致敏即可快速识别异常细胞,且NK、γδT等细胞天然无TCR蛋白,输注后GVHD风险极低,无需复杂的基因编辑。
NK细胞:NK细胞通过识别肿瘤细胞表面下调的MHC-I表达来识别和杀伤肿瘤细胞,因此不会引发GVHD;由于NK细胞主要分泌趋化因子和粒细胞-巨噬细胞集落刺激因子(GM-CSF),而不是促炎细胞因子,因此CRS发生率低;CAR-NK疗法对T细胞来源的恶性肿瘤安全性高,因为恶性T细胞和CAR-NK细胞之间没有共享抗原,降低了自相残杀的风险。
NKT细胞:NKT细胞通过直接细胞毒性和分泌细胞因子来杀伤肿瘤细胞,其杀伤机制不依赖HLA,因此不会引发GVHD;NKT细胞可以通过分泌细胞因子来调节NK细胞和树突状细胞的免疫反应,从而增强抗肿瘤反应;双特异性CAR-iNKT细胞通过双重功能设计,既可以突破肿瘤免疫抑制微环境,又能维持长期免疫监视功能,从而增强其抗肿瘤活性。
γδT细胞:与传统αβT细胞不同,γδT细胞的杀伤机制不依赖HLA和抗原呈递细胞,使其能够有效地靶向缺乏特异性肿瘤相关抗原的实体瘤;CAR-γδT细胞表现出高水平的细胞毒性,并且在基础条件下表达高水平的IFN-γ,表明其高效的杀伤能力。
3. iPSC衍生技术:干细胞“克隆工厂”
-原理:利用iPSC分化成T细胞或NK细胞,进行预先制备和储存,实现大规模生产和应用。
标准化产品:iPSC衍生的细胞可以进行基因编辑和优化,生产出标准化、高质量的细胞产品,保证治疗效果的一致性。
提高治疗效果:iPSC衍生的CAR细胞可以表达记忆表型,具有更强的自我更新能力和肿瘤靶向能力,从而提高治疗效果和持久性。
减少基因编辑步骤:iPSC衍生的细胞可以直接进行基因编辑,无需进行繁琐的细胞分离和纯化步骤,进一步提高生产效率并降低成本。
四、通用型细胞疗法正在面临哪些挑战?
要实现细胞治疗的“通用化”,需要克服以下几个关键挑战:
1. 免疫排斥:异体细胞的“隐身”难题
-挑战根源:
*T细胞攻击*:患者T细胞通过HLA-I/II分子识别异体细胞,引发宿主抗移植物反应(HvGR)。
*NK细胞杀伤*:HLA敲除后触发NK细胞的“缺失自我”反应。
*抗体介导排斥*:预存抗体或新抗体中和治疗细胞。
-解决策略:
*多重基因编辑*:通过基因编辑技术,实现TCR/HLA双敲除,降低细胞被宿主免疫系统识别和清除的风险。
*过表达“别杀我”信号*:引入CD47(结合巨噬细胞SIRPα)、HLA-E/G(抑制NK细胞),提升细胞存活率。
*表观遗传调控*:降低HLA表达水平,逃避免疫细胞杀伤,延长细胞存活时间。
*抗体中和*:表达IgG降解酶(IdeS)或截短CD64,清除预存抗体。
2.疗效持久性:细胞存活与功能维持
-挑战根源:
*体内存活期短*:异体CAR-T在血液瘤中存活仅数周,而自体疗法可达数年。
*肿瘤微环境(TME)抑制*:TGF-β、腺苷等因子导致细胞耗竭。
-解决策略:
*优化细胞类型*:选择合适的细胞类型和来源,保证细胞质量和数量;优化细胞制备和培养条件,保证细胞的活性和功能;
*代谢适应性改造*:通过过表达腺苷脱氨酶(ADA)或敲除乳酸受体(GPR81)等,抵抗TME代谢抑制。
*增强细胞耐久性*: 通过基因编辑、细胞因子和信号通路调节等方法,延长细胞的存活时间。
3.安全性风险:基因编辑与长期毒性
-挑战根源:
*基因编辑脱靶*:CRISPR可能误伤致癌基因(如p53)。
*致瘤性残留*:iPSC分化中未成熟细胞可能形成畸胎瘤。
*细胞因子风暴(CRS)*:异体细胞可能引发过度免疫反应。
-解决策略:
*高精度编辑工具*:采用碱基编辑/先导编辑等先进手段,降低脱靶率;
*增强靶向特异性*:选择合适的抗原靶点,并优化CAR结构,以提高靶向特异性和杀伤活性。
*自杀基因/安全开关*: 在出现严重副作用时,可激活自杀基因或安全开关,进一步降低CRS风险,优化安全性。
*表观遗传编辑*: 避免基因突变带来的安全性问题。
4.规模化生产:从定制化到工业化
-挑战根源:
*工艺复杂性*:通用型细胞疗法需要经过细胞培养、分化、纯化、冻存等多个步骤,对生产流程的规范性和一致性要求极高。
*多基因工程技术的挑战*:许多免疫逃逸机制都是多因素共同作用的结果,需要在细胞中同时引入多个免疫调节基因,才能有效地模拟这些机制。这需要克服基因整合和表达等方面的技术难题。
-解决策略:
*规模化生产*: 利用自动化技术和细胞培养平台,实现细胞的大规模生产。
*简化生产流程*: 开发简化的细胞制备流程,降低生产成本。
*冻存技术革新*:选择药用辅料级别高性能版冻存液,提高细胞复苏存活率。
尽管通用型细胞疗法的开发道路充满挑战,但基因编辑技术的飞速发展,特别是围绕免疫逃逸的精巧设计和工程化改造,正逐步将“通用货架型”细胞药物从概念推向临床现实。通用型细胞疗法已展现出 “改变医学范式” 的潜力——通过标准化、工业化生产,让细胞治疗从 “奢侈品” 变为 “普惠药”,这场由基因编辑、干细胞与免疫学共绘的生命科技革命,终将让“现货型”细胞药物惠及每一个需要的生命。

 友康生物
友康生物 2025-06-26
2025-06-26 公司热点
公司热点



