美国时间12月18日,美国食品药品监督管理局(FDA)批准Mesoblast公司开发的Ryoncil(remestemcel)上市,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。据悉,这是美国首个获FDA批准的间充质基质细胞(MSC)疗法。这标志着全球的间充质干细胞投资和开发必然迎来一个崭新的时代。
FDA生物制品评估与研究中心(CBER)主任Peter Marks医学博士、哲学博士说道:“今日的决定是创新细胞疗法治疗危及生命疾病历程中的关键里程碑,这些疾病对包括儿童在内的患者造成了毁灭性的影响。首次批准间充质基质细胞疗法彰显了FDA致力于支持开发安全有效产品的决心,此类产品有望改善对其他疗法无反应患者的生活质量。”

何为间充质基质细胞?
本次获批的间充质基质细胞和我们常提及的间充质干细胞有什么不一样呢?本质上它们指的是同一种细胞,只是命名方式的争议。
间充质干细胞来源广泛,可以来源于骨髓、脐带、脂肪、胎盘、牙髓等众多组织。因此其名称也很多,如骨髓基质细胞(marrow stromal cells)、多能基质细胞(multipotent stromal cells)、中胚层干细胞(mesodermal stem cells)、间充质基质细胞(mesenchymal stromal cells)等,它们描述的都是同一群细胞,简写都是 MSC。
本次获批的间充质基质细胞在FDA的原文中被称为mesenchymal stromal cell,起因是一些科学家将 MSC 称为“基质”细胞,因为他们不赞成把这些细胞归为干细胞。而间充质基质细胞(MSCs)则更多地被用来描述那些在组织支持基质中发现的细胞,它们可能也具有分化成某些细胞的潜能,但是并不会强调它们的分化潜能。
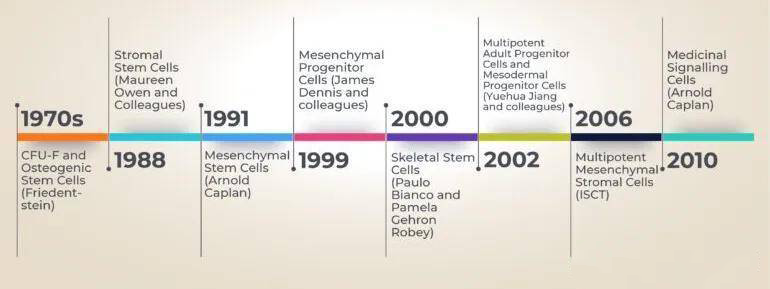
间充质干细胞命名的时间线
国内同类产品如何跟上商业化步伐?
FDA作为全球最严格的药品和医疗器械监管机构之一,也是细胞疗法审批的行业风向标,在本次干细胞药物的批准公告中,强调了其“致力于支持开发安全有效产品的决心”。这意味着,任何干细胞疗法在出海前,都必须经过严格的安全性、有效性和质量可控性评估,确保产品能够在正常使用条件下不会对人体产生严重不良反应,同时提供充分的数据证明其在治疗特定疾病方面具有确切疗效。
细胞疗法成药的必要条件之一就是细胞要在一个稳定的生长环境里培养。要满足这种稳定的培养环境,就需要培养基必须是化学成分完全明确的,不存在未知的因子、蛋白等,这样才能完全保证培养环境的稳定性和安全性,使细胞药物质量稳定。
今年9月份,友康生物的间充质干细胞无血清培养基在美国FDA的510K二类医疗器械注册获得批准,注册证号K232543,是美国FDA发放的全球第2个,中国首个该产品的注册证。该产品是化学成分完全明确的完全培养基,经过严格的技术检测,已经证明和美国市场上销售的同类产品在安全性和有效性上实质等同。
友康生物细胞治疗级干细胞培养平台
友康生物凭借着在干细胞领域的多年积淀,形成了集细胞培养、细胞消化、细胞冻存、三系分化鉴定、细胞无菌检测于一体的临床申报级干细胞培养解决方案,均为无血清体系干细胞药物申报而开发,不仅产品性能出色,工艺、质量也更稳定严格,符合临床申报对工艺和质量一致性的要求。
目前,友康生物已完成7个产品在美国FDA的DMF备案,并被相关药企注册关联4个产品,与2家中国企业在美国进行干细胞药物与免疫细胞药物的联合申报,并获批IND;与18家中国企业在中国合作进行干细胞与免疫细胞药物联合申报并获批IND。
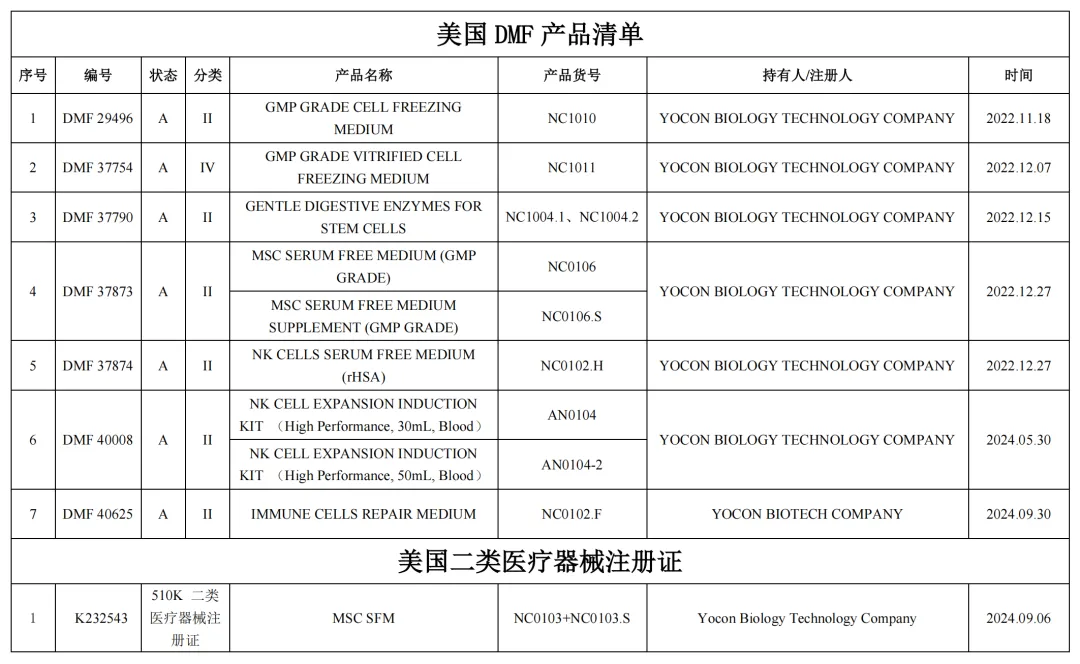
友康生物产品在美国注册备案清单

 友康生物
友康生物 2025-02-10
2025-02-10 公司热点
公司热点



